近日,药学院翟光喜教授、杨小叶副研究员团队在国际期刊Chemical Engineering Journal杂志上发表了题为“Intelligent self-amplifying ferroptosis-inducible nanoplatform for enhanced tumor microenvironment reconstruction and combination therapy”的研究性论文(中科院1区top期刊),翟光喜教授与杨小叶副研究员为共同通讯作者,硕士研究生孔欣茹为第一作者,山东大学为独立通讯作者单位。
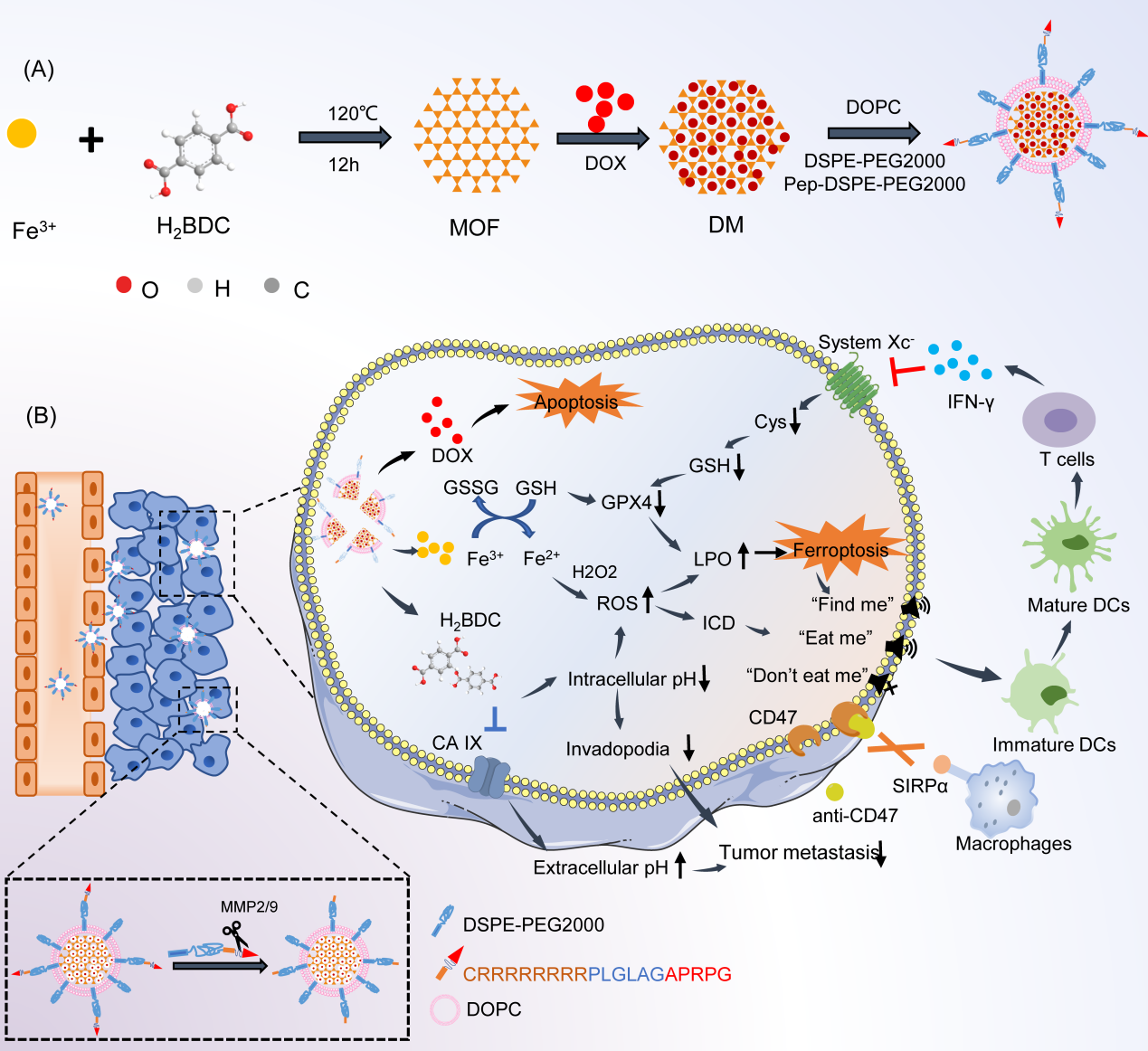
化疗药物阿霉素(DOX)的临床使用受到严重毒性和肿瘤细胞中存在的抗凋亡机制的限制。为了解决这一挑战,翟光喜教授和杨小叶副研究员团队制备了一种名为p-LDM的DOX递送纳米平台,用于降低DOX的毒性并增加其疗效。文章验证了DOX诱导的凋亡可以与铁死亡激活相结合,以获得更强的细胞杀伤和免疫激活活性,并且首次证实了碳酸酐酶IX(CA IX)抑制可以增敏铁死亡。p-LDM的内部金属有机骨架(MOFs)核心由Fe3+和对苯二甲酸(H2BDC)组成,其中Fe3+诱导4T1细胞铁死亡,H2BDC通过其CA IX抑制作用增强铁死亡。在这一自增强的设计中,Fe3+和H2BDC不仅作为MOFs的结构成分,还协同发挥了强大的铁死亡激活作用,为克服细胞内酸度不足对铁死亡的限制提供了一种新方法。联合应用p-LDM和CD47-SIRPα阻断治疗,观察到铁死亡增强,这可能与CD47-SIRPα阻断介导的干扰素γ(IFN-γ)水平上调和胱氨酸/谷氨酸反向转运蛋白(System Xc-)抑制有关。“找到我”和“吃我”信号的释放与被抑制的CD47释放的“不要吃我”信号共同重塑了受抑制肿瘤免疫微环境,对肿瘤的生长、转移和复发有更强的协同抑制作用。综上,该研究设计了一种新型的肿瘤特异性纳米递药系统(p-LDM)用于DOX的递送,为增强基于铁死亡激活的肿瘤治疗提供了新方法。联合p-LDM与CD47-SIRPα阻断治疗可以触发更强的肿瘤铁死亡、肿瘤生长抑制和免疫抑制微环境重塑,为p-LDM的应用创造了更多的可能性。
近年来,翟光喜教授团队在铁死亡、抗肿瘤免疫治疗等方面取得了一系列重要成果,先后发表于Biomaterials,Acta Biomaterialia,Nano Today等期刊上。该项工作得到了“重大新药创制”国家科技重大专项、国家自然科学基金、山东省自然科学基金、山东省泰山产业专家计划的资助。
论文链接:https://doi.org/10.1016/j.cej.2023.143729。
